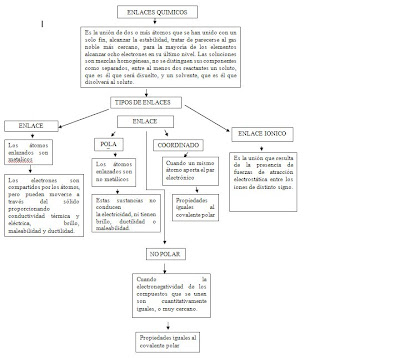
¿Qué es enlace químico?
R: unión entre dos o más átomos para formar una molécula o una estructura cristalina.
¿Qué tipo de enlaces químicos existen?
R: Enlace Metálico, Enlace Covalente (Covalente Polar, Covalente No Polar, Covalente Cordinado), Enlace Iônico.
¿Que es un enlace metálico?
Los átomos enlazados son metálicos. Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.
¿Cuáles son las propiedades de un enlace metálico?
Suelen ser solidos a temperatura ambiente, excepto el mercurio y sus puntos de fusión y ebullición varían notablemente.
Las conductividades térmicas y eléctricas son elevadas.
Presentan brillo metálico, por lo que son menos electronegativos.
Son dúctiles y maleables.
Pueden emitir electrones cuando reciben energía en forma de calor.
Tienden a perder electrones de sus últimas capaz cuando reciben cuantos de luz (Fotones).
Tienen puntos de fusión y ebullición altos.
¿Cuáles son las propiedades de un enlace covalente?
La diferencia de la electronegatividad es menor que 1.7.
Tienen puntos de fusión bajos.
La mayoría son gases o líquidos.
Tienen puntos de ebullición bajos.
No son buenos conduciendo la electricidad.
Para deshacer el compuesto se necesitan grandes cantidades de energía.
¿Qué es un enlace covalente polar?
Los átomos enlazados son no metálicos. Estas sustancias no conducen la electricidad, ni tienen brillo, ductilidad o maleabilidad.
¿Cuáles son las propiedades de un enlace covalente polar?
La diferencia de electronegatividad es mayor que 1.7
Presentan gran actividad química.
Son solubles en solventes polares.
Existen en los tres estados de la materia.
Sus puntos de fusión y ebullición son bajos.
Algunos en solución acuosa conducen electricidad
¿Qué es un enlace covalente no polar?
Cuando la electronegatividad de los compuestos que se unen son cuantitativamente iguales, o muy cercano.
¿Cuáles son las propiedades de un enlace covalente no polar?
La diferencia de la electronegatividad es menor que 0.4
Sus moléculas son diatòmicas.
Su actividad química es media.
Tienen puntos de fusión y ebullición bajos.
Pueden ser solidos o líquidos.
No conducen electricidad ni calor
¿Qué es un enlace covalente cordinado?
Cuando un mismo átomo aporta el par electrónico
¿Qué es un enlace iónico?
Es la unión que resulta de la presencia de fuerzas de atracción electrostática entre los iones de distinto signo.
¿Cuáles son las propiedades de un enlace iónico?
§ Se da entre metales y no metales.
§ El metal se convierte en catiòn y el no metal en anion.
§ En estado solido no conducen la electricidad ni el calor, solo disueltos regularmente en agua.
§ Los solventes polares se dividen en carga negativa y positiva.
§ La diferencia de la electronegatividad de los elementos del enlace es menor o igual que 1.7.
R: unión entre dos o más átomos para formar una molécula o una estructura cristalina.
¿Qué tipo de enlaces químicos existen?
R: Enlace Metálico, Enlace Covalente (Covalente Polar, Covalente No Polar, Covalente Cordinado), Enlace Iônico.
¿Que es un enlace metálico?
Los átomos enlazados son metálicos. Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.
¿Cuáles son las propiedades de un enlace metálico?
Suelen ser solidos a temperatura ambiente, excepto el mercurio y sus puntos de fusión y ebullición varían notablemente.
Las conductividades térmicas y eléctricas son elevadas.
Presentan brillo metálico, por lo que son menos electronegativos.
Son dúctiles y maleables.
Pueden emitir electrones cuando reciben energía en forma de calor.
Tienden a perder electrones de sus últimas capaz cuando reciben cuantos de luz (Fotones).
Tienen puntos de fusión y ebullición altos.
¿Cuáles son las propiedades de un enlace covalente?
La diferencia de la electronegatividad es menor que 1.7.
Tienen puntos de fusión bajos.
La mayoría son gases o líquidos.
Tienen puntos de ebullición bajos.
No son buenos conduciendo la electricidad.
Para deshacer el compuesto se necesitan grandes cantidades de energía.
¿Qué es un enlace covalente polar?
Los átomos enlazados son no metálicos. Estas sustancias no conducen la electricidad, ni tienen brillo, ductilidad o maleabilidad.
¿Cuáles son las propiedades de un enlace covalente polar?
La diferencia de electronegatividad es mayor que 1.7
Presentan gran actividad química.
Son solubles en solventes polares.
Existen en los tres estados de la materia.
Sus puntos de fusión y ebullición son bajos.
Algunos en solución acuosa conducen electricidad
¿Qué es un enlace covalente no polar?
Cuando la electronegatividad de los compuestos que se unen son cuantitativamente iguales, o muy cercano.
¿Cuáles son las propiedades de un enlace covalente no polar?
La diferencia de la electronegatividad es menor que 0.4
Sus moléculas son diatòmicas.
Su actividad química es media.
Tienen puntos de fusión y ebullición bajos.
Pueden ser solidos o líquidos.
No conducen electricidad ni calor
¿Qué es un enlace covalente cordinado?
Cuando un mismo átomo aporta el par electrónico
¿Qué es un enlace iónico?
Es la unión que resulta de la presencia de fuerzas de atracción electrostática entre los iones de distinto signo.
¿Cuáles son las propiedades de un enlace iónico?
§ Se da entre metales y no metales.
§ El metal se convierte en catiòn y el no metal en anion.
§ En estado solido no conducen la electricidad ni el calor, solo disueltos regularmente en agua.
§ Los solventes polares se dividen en carga negativa y positiva.
§ La diferencia de la electronegatividad de los elementos del enlace es menor o igual que 1.7.
config electronica de los gases
He 2
Helio
1s2
Electrones en la última capa: 2 e-
Ne10
Neon
1s2, 2s2, 2s6
Electrones en la última capa: 8 e-
Ar18
Argon
1s2, 2s2, 2p6, 3s2, 3p6
Electrones en la última capa: 8 e-
Kr36
Criptón
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6
Electrones en la última capa: 8 e-
Xe54
Xenón
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6
Electrones en la última capa: 8 e-
Rn86
Radon
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6
Electrones en la última capa: 8 e-
Conclusiones:
Las similitudes entre estos gases nobles es que todos ellos tienen saturadas sus últimas capas con 8 e- (con excepción del Helio que su capa solo soporta 2 e-), por lo que los hace los átomos mas estables.
¿Qué conducta podemos esperar de estos átomos con relación a la formación de los enlaces químicos?
Siendo que estos gases nobles tienen saturada sus últimas capas, será mas difícil para ellos formar enlaces químicos iónicos y siendo que no pueden reaccionar con enlaces covalentes ni metálicos, lo mas probable será que estos átomos se encuentren en una forma muy pura, por su estabilidad en los electrones.
Helio
1s2
Electrones en la última capa: 2 e-
Ne10
Neon
1s2, 2s2, 2s6
Electrones en la última capa: 8 e-
Ar18
Argon
1s2, 2s2, 2p6, 3s2, 3p6
Electrones en la última capa: 8 e-
Kr36
Criptón
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6
Electrones en la última capa: 8 e-
Xe54
Xenón
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6
Electrones en la última capa: 8 e-
Rn86
Radon
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6
Electrones en la última capa: 8 e-
Conclusiones:
Las similitudes entre estos gases nobles es que todos ellos tienen saturadas sus últimas capas con 8 e- (con excepción del Helio que su capa solo soporta 2 e-), por lo que los hace los átomos mas estables.
¿Qué conducta podemos esperar de estos átomos con relación a la formación de los enlaces químicos?
Siendo que estos gases nobles tienen saturada sus últimas capas, será mas difícil para ellos formar enlaces químicos iónicos y siendo que no pueden reaccionar con enlaces covalentes ni metálicos, lo mas probable será que estos átomos se encuentren en una forma muy pura, por su estabilidad en los electrones.

1 comentario:
Hola chicos, respecto a la actividad 1 tienen 9.0 ya que dejan fuera varias cosas como proporcionar ejemplos, concretar en características particulares.
En la actividad 2: únicamente contestan una pregunta, tienen 8.0
En la actividad 3: tienen 10 está completa.
ok, nos vemos.
Atentamente su maestra de química.
Publicar un comentario